RNA甲基化是表观遗传学领域的研究热点,也是高分文章的宠儿,目前大热点有m6A、m5C、m1A RNA甲基化,尤其m6A修饰热度只增不减,那么,本期我们继续m6A。这次分享的文章是发表在Nature Cell Biology上的“Stage-specific requirement for Mettl3-dependent m6A mRNA methylation during haematopoietic stem cell differentiation”,文章是关于造血干细胞(HSC)的研究,也关于m6A,主角分子依旧是Mettl3蛋白。

本文所有图片及数据均来源于:Lee, H., et al. "Stage-specific requirement for Mettl3-dependent m6A mRNA methylation during haematopoietic stem cell differentiation." Nature cell biology (2019).
研究背景:造血干细胞(HSCs)维持平衡的自我更新和分化,但这些功能如何被精确调节尚不完全清楚。m6A mRNA甲基化已成为影响许多生物过程中转录基因表达调控的重要模式。基于这些,作者开展了实验。利用Lysm-cre转基因技术小鼠Mettl3条件敲除后,髓系细胞的数量和功能并未被影响HSCs分化受阻。Myc的转录本是m6A最主要修饰靶基因,对HSC细胞进行MeRIP-seq,发现,Mettl3缺失的HSC细胞中,MYC的表达量下降,挽救实验中增加分化刺激因素或者人为上调表达MYC基因,都可以使得挽救HSC的分化功能缺陷。
研究结果:
1、Mettl3蛋白敲除后HSC细胞大量堆积
根据已有研究报道,HSCs可以直接产生血小板,通过腹膜注射pIpC到敲除Mettl3的Mx1-cre中,通过全血细胞计数分析显示Mx1-cre中血小板计数显着降低;Mettl3fl/fl小鼠与pIpC处理的对照相比,白细胞计数也显著降低且分布改变,这表明m6A与造血功能相关;在pIpC最后一次注射,10天时,Mettl3的缺失导致髓系细胞的数量显著减少,脾细胞无变化;注射后2-4个月,除髓系细胞的数量显著减少之外,脾脏大小及细胞构成反而增加;在骨髓中,LSK和HSCs在检测的时间点都有增加,且HSCs在最后一次pIpC注射后10-14天到4个月持续增加,而LSK只是略有增加;另外,观察到Lin-Scal-cKit+CD150+CD41巨核细胞和CD41巨核细胞与对照相比显著增加。所有相关数据表明Mettl3的丧失导致HSC细胞堆积,并且影响巨核细胞谱系。
2、Mettl3蛋白缺失阻碍HSCs正常分化
BrdU注射Mx1-cre鼠,检测细胞周期、细胞死亡等指标,结果发现:Mettl3fl/fl小鼠与对照相比,BrdU掺入并没有大的差异,但是细胞死亡显著增加;另外,使用5-氟尿嘧啶处理pIpC注射的Mx1-cre小鼠时,Mettl3fl/fl小鼠的存活率低于对照组;这说明HSCs的积累可能是分化受阻而非自我更新增强。而后作者进一步利用甲基纤维素检测HSCs的分化能力,与对照相比,丧失Mettl3的HSCs形成集落更少且菌落更小,作者利用流式细胞术分析,发现这些细胞是不能分化的;但是,当Mettl3缺陷的髓系细胞接种到甲基纤维素中时,与对照相比,形成的集落在数量,大小和类型上相似,且这些菌落含有正常数量的分化细胞。这表明Mettl3的缺失导致HSCs的分化受阻,但在体外限制性祖细胞中不存在此现象。
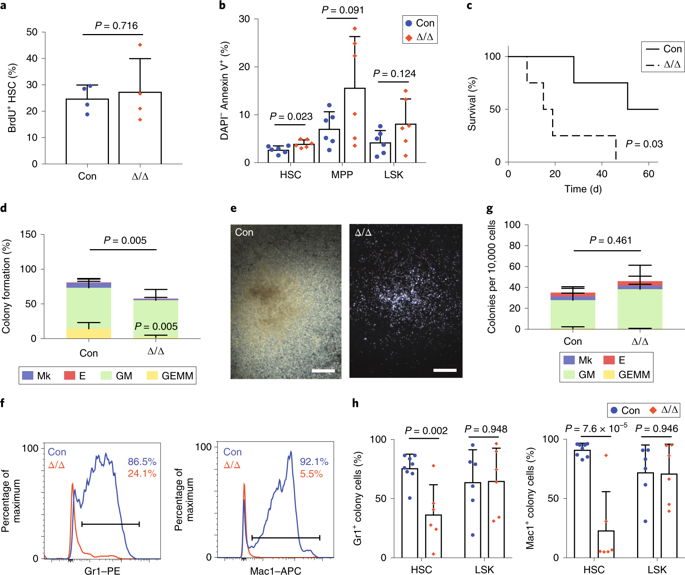
3、Mettl3是HSCs分化过程的必需分子
为了测试Mettl3的缺失是否导致体内HSCs缺陷,作者通过利用Mx1-cre的500,000个髓系细胞进行竞争性重组测定。 发现HSCs水平有降低趋势;作者将Mettl3缺陷型和对照HSCs以及野生型竞争性髓系细胞分选出来,并移植到致死量照射的小鼠中,移植对照HSCs的受体鼠能够重组主要造血谱系,但缺乏Mettl3的HSCs不能重组,缺陷主要发生在骨髓和B谱系中,且缺乏Mettl3的HSCs在自我更新上基本是正常的,但是随着分化层次推移,所分化的造血细胞逐渐减少;这表明Mettl3缺陷型HSCs在造血重组方面存在缺陷,且Mettl3是HSCs分化过程的所必需的。
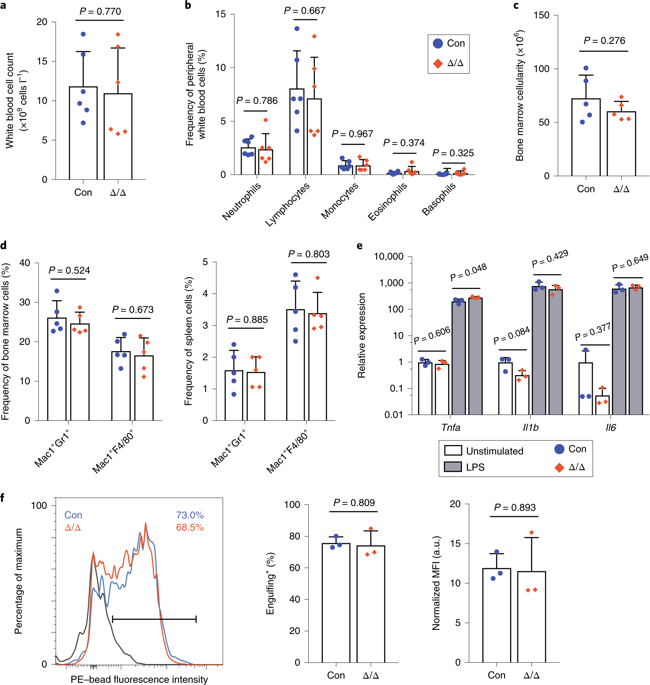
4、骨髓细胞生成不需要Mettl3
作者在Lysm-cre中敲掉Mettl3蛋白,6-8周龄的鼠各细胞参数正常(外周血、骨髓、脾细胞等参数),且都可以形成正常形态的巨噬细胞;当受到脂多糖攻击时,显示出的炎性细胞因子Tnfa,Il1b和Il6均正常上调;Mettl3缺陷型骨髓细胞也显示出强烈的吞噬活性,这个现象与对照相似;这说明Mettl3不是成熟骨髓细胞维持功能所必需的,但HSCs在体内造血分化期间对Mettl3和m6A的阶段特异依赖。
5、鉴定HSC中与m6A作用的靶基因
利用MeRIP-seq技术鉴定,发现在对照小鼠中,富集了2073个转录产物,而在Mettl3缺陷型HSCs的Mx1-cre中,经过pIpC处理10天,只富集了995个转录产物,与对照相比,显著降低;这说明m6A修饰与Mettl3蛋白的表达密切相关。此外,Myc, Junb 和 Tet2被认为是m6A修饰的主要靶基因,在Mettl3缺陷型HSCs中,这些基因的表达量也下调。
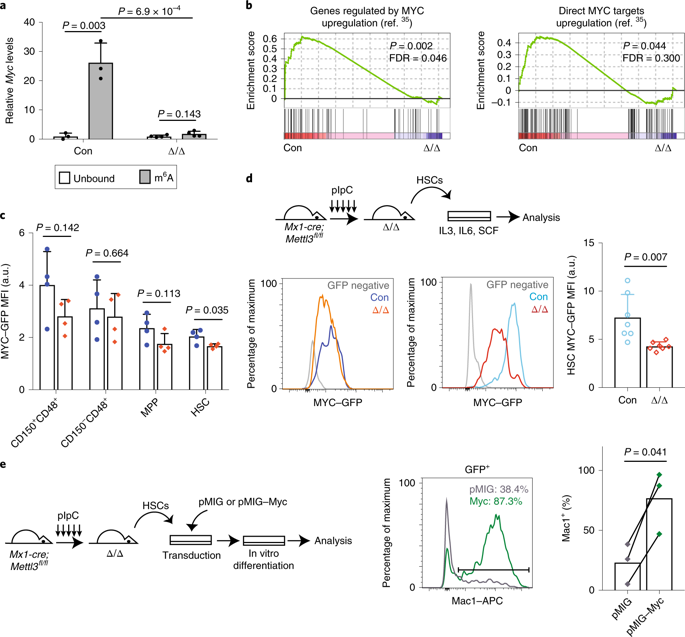
6、Mettl3介导的m6A会改变HSCs特性
作者在Mettl3缺陷型HSCs中找到384个上调基因,其中95个是m6A靶标,将基因分为m6A靶基因和非m6A靶基因,通过MeRIP-seq,发现与非m6A靶标相比,m6A靶标的转录物在Mettl3缺陷型HSC中具有略微增加的丰度,根据已有研究报导,在HSC中MYC蛋白水平非常低,在通过转录机制进行分化后被上调,MYC的缺失阻断HSCs分化,而更高水平的MYC蛋白可以促进HSCs分化,这个现象与Mettl3缺陷型HSCs的表型相似,因此,作者进一步通过MeRIP-seq技术检测,发现Mettl3缺陷型HSCs中MYC转录物水平没有显著变化,但是,GSEA基因富集分析结果发现Mettl3缺陷型HSCs中Myc-靶基因特征的显着降低,表明m6A可能主要调节Myc mRNA翻译,进一步在MYC蛋白中插入GFP蛋白,用来检测MYC蛋白表达量,结果:Mettl3的缺失导致HSCs中MYC-GFP的表达显着降低,在激活HSCs分化后,对照HSCs的MYC-GFP表达上调,而Mettl3缺失型HSCs的MYC-GFP表达不能上调,这说明m6A是HSC中Myc mRNA翻译所必需的,特别是在分化后。并且将Myc强制表达可以挽救由Mettl3缺失引起的HSCs分化缺陷。
文章总结:利用Lysm-cre转基因技术小鼠Mettl3条件敲除后,髓系细胞的数量和功能并未被影响,但HSCs分化受阻;Myc的转录本是m6A最主要修饰靶基因,对HSC细胞进行MeRIP-seq,发现,Mettl3缺失的HSC细胞中,MYC的表达量下降,挽救实验中增加分化刺激因素或者人为上调表达MYC基因,都可以使得挽救HSCs的分化功能缺陷;Mettl3所介导的m6A是HSCs分化过程中所必须的。










 首页
首页
 关于我们
关于我们
 产品中心
产品中心
 仪器中心
仪器中心
 新闻中心
新闻中心
 资料下载
资料下载
 在线留言
在线留言
 人才招聘
人才招聘
 联系我们
联系我们