基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
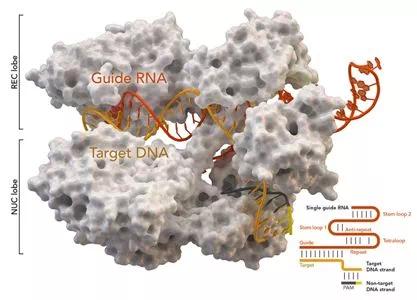
图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
过去的5月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下CRISPR/Cas研究方面的新闻,供大家阅读。
1
Science子刊:经过CRISPR编辑的B细胞产生抗体,对抗难以治疗的病毒
doi:10.1126/sciimmunol.aax0644
尽管进行了数十年的研究,但尚未有得到批准的疫苗能够长期预防流感病毒、爱泼斯坦巴尔病毒(EBV)或呼吸道合胞病毒(RSV)。比如,对作为一种引起呼吸道感染的病原体的RSV而言,高风险婴儿每月接受合成抗体注射,以便在短期内保护这些婴儿。近年来,几组研 究人员探索了一种不同的方法:利用免疫系统自身产生抗体的B细胞,并利用CRISPR对它们进行改造,以便在感染的情况下按要求大量表达针对这些难以治疗的病毒的抗体。
在一项新的研究中,来自美国弗雷德哈钦森癌症研究中心和华盛顿大学的研究人员通过这样做,成功地对人类和小鼠B细胞进行基因修饰来表达靶向HIV、EBV、流感病毒和RSV的抗体。他们还证实这些经过基因改造的B细胞在小鼠感染模型中阻止RSV感染。相关研究结果发 表在2019年5月17日的Science Immunology期刊上,论文标题为“B cells engineered to express pathogen-specific antibodies protect against infection”。
为了对B细胞进行修饰,弗雷德哈钦森癌症研究中心免疫学家Justin Taylor和他的团队探究了在之前研究中经证实有效对抗这四种病毒中的每一种的抗体。他们使用一种常规的CRISPR策略将编码抗体的DNA插入到在原代人B细胞的抗体编码基因上产生的小切口中。
这些研究人员设计了这种插入,使得新抗体蛋白的表达受到这些细胞自身启动子的调节,从而允许这些细胞能够像正常那样在经受病毒抗原触发后产生它们。他们将尽可能多地让这些经过修饰的B细胞分化为分泌抗体的血浆B细胞,这些血浆B细胞在它们的细胞表面上表达 这些抗体并分泌它们。
一旦这些研究人员证实这些经过修饰的B细胞中的一个合理比例确实表达这些新抗体,他们就会研究这些细胞是否在小鼠中抵抗病毒感染。他们在小鼠B细胞中重复了这个过程,诱导它们表达靶向RSV的抗体,将成功修饰的B细胞群体灌注到正常的啮齿动物中,然后等待一 段时间。六天后,RSV特异性抗体出现在它们的血清中,但没有出现在对照小鼠中。这些小鼠中的一些动物接受鼻内剂量的RSV注射,这些经过修饰的B细胞成功地抵抗这种病毒。五天之后,这些研究人员几乎没有在血液中含有这些经过修饰的B细胞的小鼠肺部中检测到任 何水平的RSV,但是他们在不含有这些B细胞的对照小鼠中发现了高水平的这种病毒。

图片来自Science Immunology, 2019, doi:10.1126/sciimmunol.aax0644。
2

Cell:首次发现阻断CRISPR-Cas9基因组编辑的小分子抑制剂
doi:10.1016/j.cell.2019.04.009
在一项新的研究中,来自美国布罗德研究所等研究机构的研究人员发现酿脓链球菌Cas9(SpCas9)的首批小分子抑制剂能够更精确地控制基于CRISPR-Cas9的基因组编辑。具体而言,他们通过开发一系列高通量生物化学分析方法和基于细胞的分析方法,筛选了许多小分子 ,以便鉴定出能够破坏SpCas9与DNA结合因而干扰它的DNA切割能力的化合物。这些首批小分子CRISPR-Cas9抑制剂很容易进入细胞,并且比之前发现的抗CRISPR蛋白小得多。这些新化合物可以对基于SpCas9的编辑技术进行可逆的和剂量依赖性的控制,包括它们在哺乳动物 细胞中进行基因编辑、碱基编辑和表观遗传编辑的应用。相关研究结果发表在2019年5月2日的Cell期刊上,论文标题为“A High-Throughput Platform to Identify Small-Molecule Inhibitors of CRISPR-Cas9”。
论文通讯作者、布罗德研究所的Amit Choudhary说道,“这些技术为快速鉴定和使用针对SpCas9和下一代CRISPR相关核酸酶的小分子抑制剂奠定了基础。靶向CRISPR相关核酸酶的小分子抑制剂具有广泛应用于基础研究、生物医学和国防研究以及生物技术应用的潜力。”
3
PLoS Biol:中国科学家评论 能天然抵御HIV感染的基因编辑婴儿真的好吗?
doi:10.1371/journal.pbio.3000224
近日,一项刊登在国际杂志PLoS Biology上的研究报告中,来自中国科学院的科学家们通过研究表示,对人类进行生殖细胞系基因编辑的首个报道案例是非常糟糕且有背伦理道德的。
文章中,研究者批评了去年在第二届基因编辑世界峰会上中国研究者贺建奎发表的研究,即其描述了利用CRISPR/Cas9基因编辑技术来修改机体中CCR5基因,该基因编码了一种HIV用于进入人体白细胞所需的特殊受体,CCR5基因在两个胚胎中进行了修饰,最后两个修饰后的女婴诞生了,研究者认为,利用基因编辑技术制造出对HIV感染产生免疫的婴儿对于其父亲为HIV阳性是非常必要的。
本文研究中,研究者认为,上述项目在多个层面上存在误解,通过已经建立的辅助生殖技术在孕期可以实现避免HIV的感染,而且在出生后通过共同的风险避免措施就能够有效避免HIV的感染,尽管天然存在的CCR5突变与一些欧洲人群对HIV的抗感染有关,但该突变并不能有效阻断所有HIV毒株的感染,而且目前尚没有研究来阐明器对中国人群的潜在健康影响,而且贺建奎并未剔除详细的计划来追踪婴儿评估其后期的健康影响。
研究者认为,贺建奎的研究工作依赖于关于分子过程和基因编辑后果的具体假设,而这些假设是具有争议性的,此外,其科学的质量并不是合格的,因为有些实验缺乏适当的复制,而且其对脱靶的分析也并不充分。贺建奎及其团队的行为严重违背了中国的法规及国际科 学界达成的共识,研究者Haoyi Wang表示,我们对此表示强烈潜在,因为其行为在科学和道德上都是非常不负责任的,有关机构应该对此进行深入调查并发布相关数据,后期还应该通过明确和严格的法律规定来规范未来科学家们对人类生殖细胞系所进行的基因编辑实验研究。
4
Science子刊:一种新型腺嘌呤碱基编辑器可让细胞RNA编辑最小化
doi:10.1126/sciadv.aax5717
在一项新的研究中,来自美国布罗德研究所和哈佛大学的研究人员发现有证据表明使用碱基编辑器会导致细胞中出现意想不到的RNA编辑。相关研究结果发表在2019年5月8日的Science Advances期刊上,论文标题为“Analysis and minimization of cellular RNA editing by DNA adenine base editors”。在这篇论文中,他们描述了他们对CRISPR类型腺嘌呤碱基编辑器(ABE)的研究,以及他们取得的发现。
ABE将一个DNA碱基对转换成另一个DNA碱基对,从而允许修复某些细胞类型中的突变,而不会产生不想要的编辑效应。据认为,ABE还有潜力校正几乎一半已知的导致医学疾病的遗传异常。ABE的科学基础对医学界来说变得越来越重要。不幸的是,最近的一些研究已发现,ABE可能也会导致意料之外的编辑。在今年3月,一个研究团队发现胞嘧啶碱基编辑器3型(CBE3)以高于正常的速率诱导单核苷酸变异。在上个月,另一个研究团队发现胞嘧啶碱基编辑器(CBE)和ABE导致RNA中的脱靶编辑。在这项新的研究中,这些研究人员试图在使用ABE时进一步测试脱靶编辑,并在确认后找到一种解决方案。
这些研究人员以一种包括人细胞系中所有细胞RNA转录本的方式分析了ABE的最新版本,称为ABEmax,而且他们使用比其他人使用的更灵敏的工具来做到这一点。他们报道他们确实在RNA样本中发现了低水平的脱靶编辑。为了解决这个问题,他们开发了在保留在靶碱基编辑的能力同时导致较少RNA编辑的新型ABE变体(基于灭活的野生型大肠杆菌)。他们进一步报道说,这些新型变体是以一种让RNA和DNA编辑过程解耦合的方式构建出来的,这样就能够最大限度地减少DNA和RNA中的脱靶编辑。

图片来自Vossman/Wikipedia。
5
PNAS:CRISPR助力人类神经细胞的寨卡病毒抗性筛选
doi: 10.1073/pnas.1900867116
寨卡病毒(ZIKV)是一种神经性和神经毒性虫媒病毒,对发育中的人类胎儿大脑会产生严重的不利影响。迄今为止,人们对ZIKV感染人类神经细胞所需的因素知之甚少。
最近,研究人员使用全基因组CRISPR-Cas9敲除筛选,在人多能干细胞(hPSC)衍生的神经祖细胞(NP)中鉴定了ZIKV宿主基因。研究人员发现,涉及乙酰肝素硫酸化,内吞作用,内质网加工,高尔基体功能和干扰素活性的宿主因子的突变赋予细胞对ZIKV的乌干达菌株和最近的北美分离株的感染的抗性。
在人NP中鉴定的ZIKV复制必需的宿主基因也在同基因人星形胶质细胞中提供低水平的针对ZIKV的保护。
因此,该研究结果提供了对高度脆弱的人类NP细胞中ZIKV感染的宿主依赖性机制的见解,并确定了潜在治疗干预的分子靶点。










 首页
首页
 关于我们
关于我们
 产品中心
产品中心
 仪器中心
仪器中心
 新闻中心
新闻中心
 资料下载
资料下载
 在线留言
在线留言
 人才招聘
人才招聘
 联系我们
联系我们